BJN#223 L’Imlifidase un nouveau traitement pour le Goodpasture ?
Merci à Justine Serre (@justine_serre), de Paris, membre du conseil scientifique pour ce résumé.
N’hésitez pas, si vous le souhaitez, à nous envoyer vos lectures !
Cette BJN est rédigée en rapport avec cet article :
Endopeptidase Cleavage of Anti-Glomerular Basement Membrane Antibodies in vivo in Severe Kidney Disease: An Open-Label Phase 2a Study, publié par Frederik U et al. dans le JASN
Introduction
La survie rénale chez les patients atteints de Goodpasture avec une insuffisance rénale sévère au diagnostic est globalement faible. Les anticorps anti-MBG ont une pathogénicité démontrée et reproductible chez l’animal.
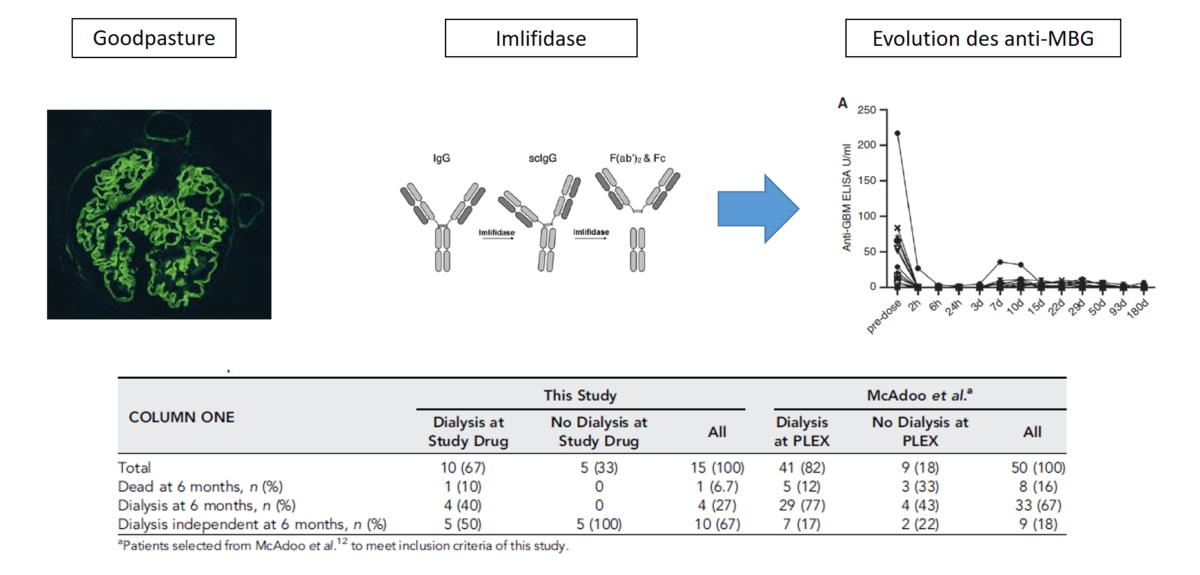
L’Imlifidase est une enzyme du Streptococcus pyogenes capable de cliver les IgG circulantes, déjà utilisée pour la désimmunisation des patients hyperimmunisés en attente de greffe rénale. L’Imlifidase a montré sa capacité à cliver les IgG anti-MBG.
L’objectif de cette étude était d’étudier le bénéfice de l’Imlifidase en plus du traitement de référence sur la survie rénale à 6 mois chez les patients ayant un Goodpasture avec une atteinte rénale sévère.
Matériels et méthodes
Les patients inclus avaient un Goodpasture avec des anticorps circulants anti-MBG, une atteinte rénale sévère avec un DFG < 15ml/min/1.73m². Etaient exclus les patients anuriques depuis plus de 48h ou dialysés depuis plus de 5 jours ainsi que les patients avec une atteinte pulmonaire modérée à sévère.
Une dose unique d’Imlifidase à 0.25mg/kg IV était administrée à 24h de l’inclusion en plus du traitement standard comprenant : des boli de corticoïdes relayés per os, du cyclophosphamide et des échanges plasmatiques dont la durée était adaptée au taux d’anticorps anti-MBG circulants. Les échanges plasmatiques n’étaient pas autorisés dans les 36h suivant l’administration d’Imlifidase et ne pouvaient être repris qu’en cas de rebond des anti-MBG.
Le critère de jugement principal était l’indépendance de la dialyse à 6 mois ainsi que les effets indésirables.
Les données étaient comparées à une cohorte historique dont seuls les patients ayant un DFG<15ml/min/1.73m², ayant bénéficié d’échanges plasmatiques et ayant des données de suivi disponibles à 6 mois étaient inclus.
Résultats
26 patients de 17 sites européens ont été screenés et 15 ont finalement été inclus.
L’âge médian était de 61 ans, à l’inclusion 10 patients étaient dialysés, 6 (47%) avaient une atteinte pulmonaire, l’atteinte histologique selon la classification de Berden était sclérotique à 7%, mixte 29%, à croissants 64%.
Les patients ont bénéficié du traitement, 14 patients ont bénéficié d’échanges plasmatiques avant l’inclusion dans l’étude et ils ont été repris chez 10 patients devant un rebond des anti GBM après l’Imlifidase.
A 6 mois 14 patients ont survécu, 4 (27%) patients étaient dialysés, les paramètres associés à l’absence de dialyse à 6 mois étaient l’oligurie initiale, le sexe et le niveau d’anti MBG.
50 patients de la cohorte historique ont été inclus dans l’analyse, à 6 mois 8 (13%) étaient décédés et 33 (67%) étaient dépendants de la dialyse.
Le taux de survie rénale à 6 mois était significativement plus élevé chez les patients ayant bénéficié de l’Imlifidase (p<0.001).
Le taux d’anti-MBG se négativait à H6 et il existait un effet rebond à 10 jours de la perfusion d’Imlifidase.
Les effets indésirables : 8 sévères et 83 autres, parmi les sévères : 4 infections dont une conduisant au décès d’un patient. A noter deux épisodes de thrombose veineuse profonde et 1 superficielle.
Conclusion
L’Imlifidase a permis chez des patients ayant un Goodpasture avec une atteinte rénale sévère de diminuer rapidement le taux d’anti-MBG circulants et semble avoir stoppé la progression de la maladie. Le bénéfice thérapeutique reste à démontrer dans un essai randomisé.
Les plus du papier :
Nouvelle stratégie thérapeutique dont le bénéfice reste à démontrer dans un essai randomisé.
Les critiques
Comparaison à une cohorte historique dans laquelle le pourcentage de patients dialysés au diagnostic était supérieur à celui de l’étude.
Les critères d’inclusions n’incluaient pas de PBR, 3 patients inclus n’avaient pas de dépôts d’anti-MBG.