BJN#165 – Prédire l’IRA…suPAR easy ?
Cet article du BJN est rédigé en rapport avec les références bibliographiques suivantes :
Hayek SS, Leaf DE, Samman Tahhan A, Raad M, Sharma S, Waikar SS, Sever S, Camacho A, Wang X, Dande RR, Ibrahim NE, Baron RM, Altintas MM, Wei C, Sheikh-Hamad D, Pan JS, Holliday MW Jr, Januzzi JL, Weisbord SD, Quyyumi AA, Reiser J. Soluble Urokinase Receptor and Acute Kidney Injury. N Engl J Med. 2020 Jan 30;382(5):416-426. doi: 10.1056/NEJMoa1911481. PMID: 31995687; PMCID: PMC7065830.
Lien vers l’article : Soluble Urokinase Receptor and Acute Kidney Injury
Merci à Marion Delafosse, Interne en Néphrologie à Lyon, pour cette synthèse bibliographique. Vous aussi, n’hésitez pas à nous envoyer vos lectures !
Introduction
suPAR (Soluble urokinase plasminogen activator receptor) est une glycoprotéine utilisée comme biomarqueur de l’inflammation et corrélée à la mortalité dans de nombreuses pathologies (cancer, hépatopathies, maladies cardiovasculaires). En néphrologie, elle fit beaucoup parler d’elle car suspectée d’être le facteur circulant responsable des cas de hyalinoses segmentaires et focales primitives. Des études ultérieures ont infirmé cette hypothèse, mais ont montré une forte corrélation entre le taux de suPAR et la progression de l’insuffisance rénale chronique, notamment via la surexpression de certaines intégrines au niveau podocytaire et l’altération de la barrière de filtration glomérulaire.
L’implication de suPAR en cas d’insuffisance rénale aigüe (IRA), est moins connue.
Patients/matériels et méthodes
Les auteurs ont recueilli de manière rétrospective le taux plasmatique de suPAR en per procédure de patients ayant subi une coronarographie, une chirurgie cardiaque ou lors de l’admission en soins intensifs (SI).
Le critère de jugement principal était la survenue d’une IRA à J7 (définie comme une augmentation de plus de 30µmol/L de la créatininémie en 48h ou de plus de 50% en 7 jours). Le critère de jugement secondaire était la survenue d’une IRA ou du décès à J90. Les analyses ont été réalisées en multivarié (en prenant en compte notamment les comorbidités et le DFG à l’inclusion), selon les quartiles du taux de suPAR.
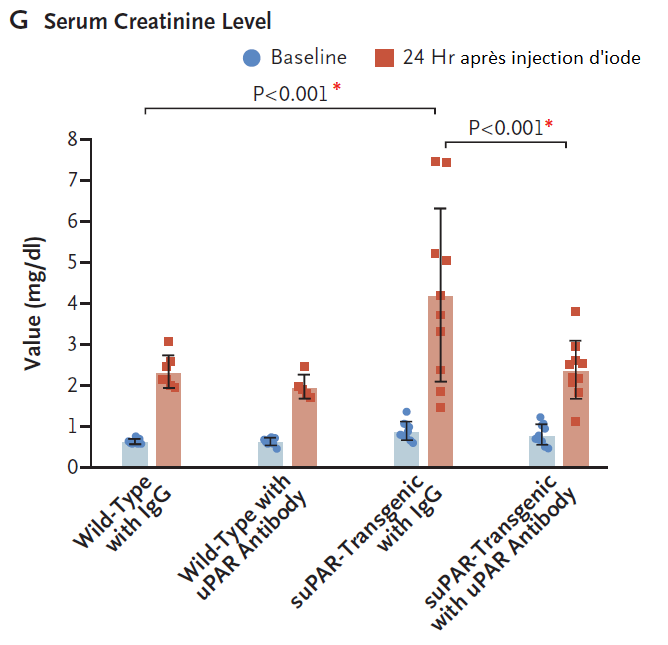
Pour étudier les mécanismes d’action de suPAR, les auteurs ont utilisé un modèle de souris transgéniques surexprimant suPAR ainsi que des cultures de cellules humaines tubulaires proximales (HK-2). L’effet d’un Ac monoclonal anti suPAR a été étudié sur ces deux modèles.
Résultats
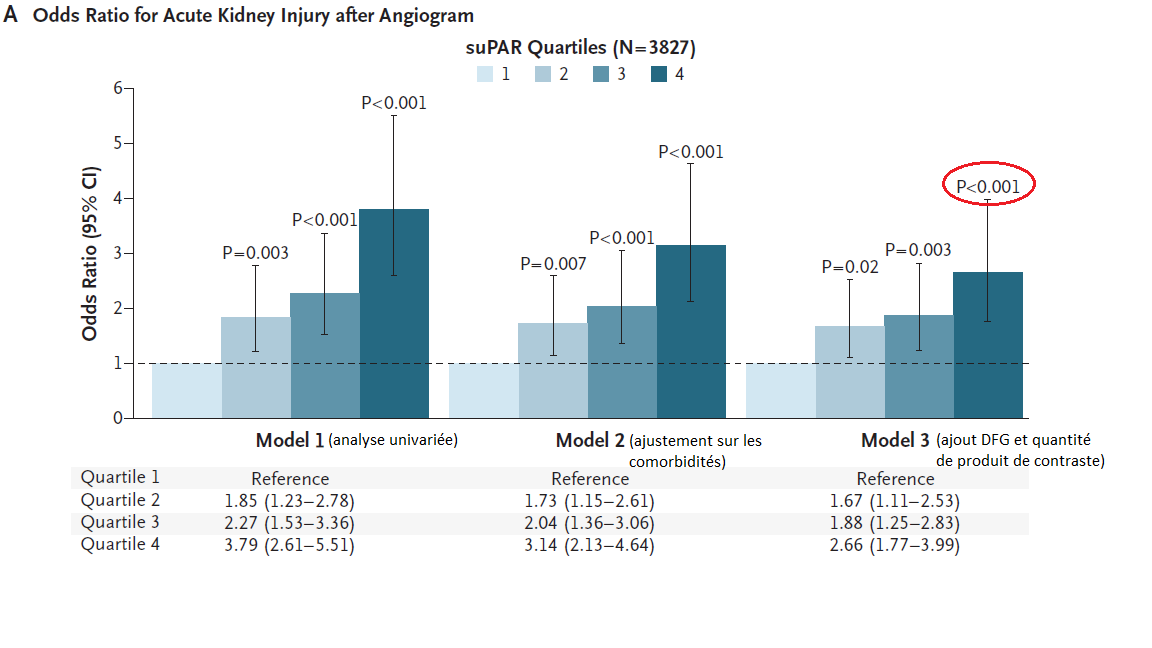
318/3827 (8%) des patients ayant subi une coronarographie ont développé une IRA (avec une augmentation moyenne de la créatininémie de 38.7µmol/L). Le risque d’IRA était de 14% dans le quartile le plus élevé pour suPAR versus 4% dans le quartile le plus bas, soit un OR en multivarié à 2.66 pour le critère de jugement principal (IC95% 1.77-3.99) et de 2.29 (IC95% 1.71-3.06) pour le critère de jugement secondaire.
De la même manière le risque d’IRA allait de 40 à 16% selon le quartile de suPAR pour les chirurgies cardiaques (250 patients inclus) et de 53 à 15% chez les patients admis en SI (692 patients inclus), avec un OR restant entre 3.5 et 4 pour le critère de jugement principal.
Dans le modèle de souris surexprimant suPAR, l’injection d’iode entrainait une élévation de la créatininémie et des altérations histologique plus sévères que chez les souris contrôles.
Pour les cellules HK-2, l’ajout de suPAR dans le milieu de culture augmentait la demande énergétique et la synthèse d’espèces réactives de l’oxygène par les mitochondries.
Dans ces deux modèles, on notait une correction de ces altérations en cas d’ajout d’un Ac anti suPAR.
Conclusion
suPAR est associé à un risque accru d’IRA dans une large cohorte de patients, probablement en lien avec une modification du métabolisme énergétique des cellules tubulaires. L’utilisation d’un inhibiteur pharmacologique de suPAR semble prometteur pour limiter ces altérations.
Les plus du papier
Papier complet, avec des données cliniques et une hypothèse physiopathologique testée sur un modèle de culture cellulaire et un modèle murin.
Inclusion d’un grand nombre de patients, avec des contextes cliniques variés.
suPAR a l’avantage par rapport à d’autres marqueurs d’IRA (NGAL ou KIM-1 par exemple) d’être élevé avant l’agression rénale, ce qui pourrait permettre la mise en place d’actions préventives plutôt que curatives.
Les critiques
Etude rétrospective à partir de cohortes historiques.
Les cas d’IRA sont majoritairement peu sévères (seulement 10% d’IRA KDIGO 2 et 3 dans la cohorte de patients ayant eu une coronarographie), limitant la valeur clinique de ce marqueur.
Selon les cohortes, les seuils de suPAR sont très variables. Quel seuil retenir en pratique clinique ?
Ne pas oublier que suPAR reste un marqueur peu spécifique de l’inflammation et qu’au-delà du risque d’IRA c’est probablement plus un marqueur de « fragilité » global.