BJN#244 – monitorer les DSA, ça sert ou ça sert pas?
Merci à Delphine Kervella, néphrologue à Nantes et co-responsable de la SFT juniors, d’avoir proposé ce résumé.
Si vous souhaitez plus d’informations sur la SFT juniors, vous pouvez visiter cette page.
Cette bibliographie est en lien avec l’article suivant: Optimized immunosuppression to prevent graft failure in renal transplant recipients with HLA antibodies (OuTSMART): a randomized control trial, publié dans eClinicalMedicine en 2023.
Introduction
On constate une perte de 30 à 40 % des transplants rénaux à 10 ans. La cause principale de perte des transplants est allo-immune (principalement lié au rejet humoral chronique). L’apparition de DSA après transplantation rénale est associée à la survenue de rejets médiés par les anticorps et à la perte du transplant. Il s’agit d’un marqueur pronostic (présence de DSA associé à la perte de transplant) et diagnostique (fait partie des critères diagnostiques des rejets médiés par les anticorps). L’apparition de DSA après transplantation (DSA de novo) signe un contrôle insuffisant de la réponse allo-immune par le traitement immunosuppresseur et est souvent associée à une mauvaise observance.
Cette étude a pour objectif de répondre à deux questions cliniques pragmatiques : Est-il utile de rechercher la présence de DSA de façon systématique chez des patients sans dysfonction du transplant ? Peut-on améliorer le pronostic du transplant en modifiant l’immunosuppression et l’observance en cas de présence de DSA ?
Méthode
Etude multicentrique au Royaume-Uni. Critères d’inclusion : >12 mois post-transplantation, DFG estimé > 30 mL/min/1,73 m².
Recherche d’anticorps anti-HLA par technique Luminex One Lambda, considéré positif si la MFI est >2000, avec classification des patients selon le résultat : pas d’anticorps anti-HLA, DSA+, Ac anti-HLA non DSA.
Les patients sont randomisés entre stratégie « blinded standard care » (SC, en aveugle, le clinicien n’aura pas les résultats de la recherche d’anticorps anti-HLA, pas de modification du traitement immunosuppresseur) et « biomarker led care » (BLC, le résultat de la recherche d’anticorps anti-HLA est notifié au clinicien avec modification du traitement selon ce résultat).
Intervention dans le groupe « biomarker led care » :
- Entretien sur l’observance médicamenteuse
- MMF/MPA aux doses maximales tolérées, Tacrolimus objectif t0 4-8 µg/mL. Possibilité de faire de faire un « boost » de corticoïdes (20 mg per os 2 semaines, puis décroissance jusqu’à maintenir 5 mg).
Une recherche supplémentaire d’Ac anti-HLA à 8 mois pour les patients sans Ac anti-HLA au premier screening (si positif change de groupe). Puis recherche d’Ac à la fin du suivi programmé.
Critère de jugement principal : délai de perte du transplant entre patients Ac anti-HLA+ SC et BLC. Suivi stoppé prématurément en mars 2020 (COVID). Durée de suivi minimum 32 mois.
Critères de jugement secondaires : délai perte transplant tous les patients BLC vs SC, survie patient, dysfonction transplant, rejet aigu prouvé par biopsie, effets indésirables (infection, cancer, diabète), rapport coût-efficacité, observance.
Résultats
2037 patients randomisés. La majorité des DSA détectés sont de novo, 23% des patients inclus ont des DSA préformés avec cross-match négatif. A la randomisation les patients sont sous Tacrolimus (73% des patients), MMF/MPA (67%), stéroïdes (55%). Triple thérapie pour 27% des patients. Suivi médian groupes DSA+ 3,9 ans [3,2-5,1 IQR], global 4,4 ans.
Critère de jugement principal :
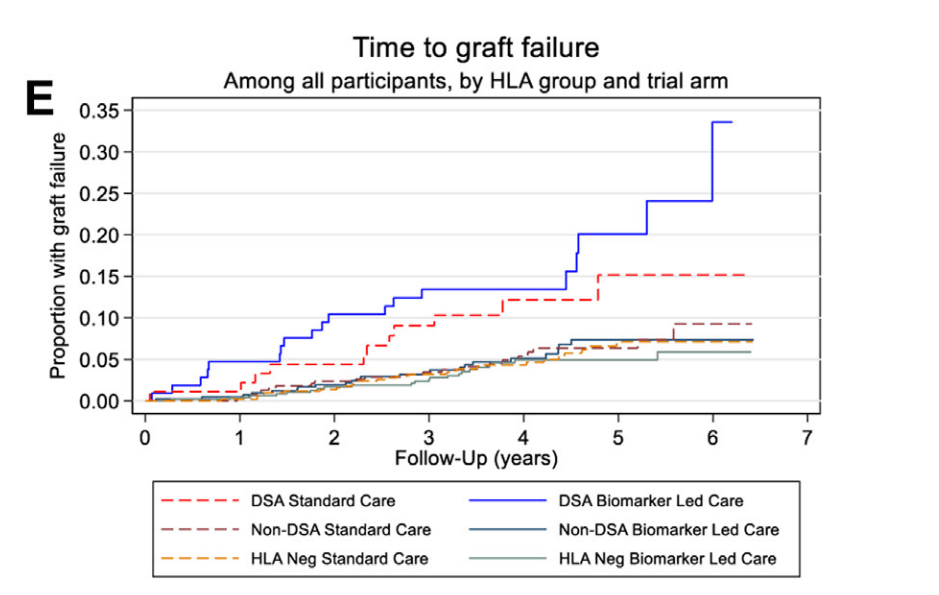
Pas de différence de survie des transplants entre stratégie BLC (intervention) et SC (aveugle) dans les groupes DSA+ (BLC vs SC HR 1,54 [IC 95% 0,72-3,30], Anti-HLA non DSA (HR 0,97 [IC 95% 0,54-1,74]) et en considérant l’ensemble des patients (HR 1,02 [0,72-1,44]). La figure illustre le délai de perte du transplant dans les 6 groupes, mettant bien en évidence la différence de perte du transplant entre les groupes DSA + et les autres groupes, sans différence entre les groupes BLC et SC pour chaque catégorie (DSA+, anti-HLA non DSA, pas d’Ac anti-HLA).
Critères de jugement secondaires (différences entre BLC et SC) :
- Pas de différence survie patient
- Moins de rejets stratégie BLC vs SC (si uniquement groupes DSA+ considérés non significatif (petits effectifs) : 10 rejets (dont 8 ABMR) groupe BLC vs 5 (dont 2 ABMR) groupe SC)
- Pas de différence effets indésirables
- Pas de différence DFG et protéinurie
- Coût-efficacité non prouvée : pas de différence de QALY (quality-adjusted life years) entre les deux groupes, avec coût plus élevé (non significatif) dans le groupe BLC
- Observance : pas de différence pour le tacrolimus, mais observance rapportée par le patient comme meilleure pour MMF et stéroïdes dans le groupe DSA + BLC vs SC.
- meilleure pour MMF et stéroïdes dans le groupe DSA + BLC vs SC.
L’intervention thérapeutique a-t-elle été vraiment effective ?
Pas de modification de la proportion de patients sous tacrolimus/MMF/stéroïdes/triple thérapie entre début et fin de l’étude dans les groupes SC (aveugle). Dans les groupes DSA + et anti-HLA non DSA BLC, augmentation de la proportion de patients sous tacrolimus/MMF/stéroïdes/triple thérapie entre début et fin de l’étude (pour le groupe DSA + BLC pourcentages de patients traités au début et à la fin de l’étude : Tacrolimus 64%>82% (p<0,001), MMF 59%>73% (p=0,02), Stéroïdes 59%>76% (p<0,001), triple thérapie 23%>48% (p<0,001)). Néanmoins le taux résiduel de tacrolimus moyen à la fin du suivi n’est pas différent entre BLC et SC chez les DSA+ (6,8 +/- 2,4 vs 6,6 +/- 2,6 ug/mL).
A la fin du suivi, on observe une diminution du nombre de patients avec anticorps anti-HLA non DSA (50 % sont négatifs) et DSA (38 % sont négatifs), de façon similaire dans les groupes BLC et dans le groupe SC.
Conclusions
Confirmation dans une étude prospective de grand effectif de l’impact négatif de l’apparition de DSA sur la survie du transplant rénal.
Pas d’impact de l’optimisation de l’immunosuppression orale pour prévenir la perte du transplant en cas de DSA détecté après un an post-transplantation sans dysfonction de l’organe.
Nécessité de tester d’autres stratégies/interventions thérapeutiques.
Forces de l’étude
Premier essai randomisé à tester une intervention thérapeutique en cas de détection de DSA sans dysfonction.
Nombre conséquent de patients
Critère de jugement clinique « dur » : la survie du transplant.
Modification du traitement immunosuppresseur bien documentée.
Limites de l’étude
Pas d’évaluation histologique au moment de la détection de DSA, pour rechercher la présence d’un rejet infraclinique. Dans une cohorte française la prévalence de rejet médié par les anticorps infraclinique au moment de la détection de DSA était de 40%, avec un moins bon pronostic pour ces patients vs ceux qui ont DSA mais pas de rejet. Dans une cohorte américaine la prévalence de rejet médié par les anticorps infraclinique était de 25% et 53% au moment de la détection des DSA et un an après. Dans l’étude OUTSMART il n’y a pas de biopsie (c’était prévu dans le design initial de l’étude mais n’a pas été accepté dans le processus éthique/patients). Cela permettrait probablement de discriminer encore mieux des groupes de patients au pronostic différent.
Pas de suivi des DSA entre le début et la fin de l’étude, ce qui permettrait peut-être de différencier des groupes de patients (DSA persistant ou non par exemple).
Augmentation du nombre de patient sous bi ou triple thérapie mais l’augmentation de l’immunosuppression reste modeste (notamment les taux résiduels de tacrolimus sont comparables entre les groupes intervention et standard care), ce qui constitue la limite majeure de l’étude.