BJN#265: Efficacité de l’Obinutuzumab dans la Néphrite Lupique : les résultats de la phase 3 REGENCY
Merci à Anna Duval de Strasbourg, membre du conseil scientifique pour ce résumé.
N’hésitez pas, si vous le souhaitez, à nous envoyer vos lectures !
Cette BJN est rédigée en rapport avec cet article : Efficacy and Safety of Obinutuzumab in Active Lupus Nephritis, publié dans le NEJM en 2025.
Contexte
La néphropathie lupique est une complication rénale grave du lupus érythémateux disséminé (LED), nécessitant un traitement immunosuppresseur efficace. Actuellement, plus de 50% des patients avec une néphrite lupique ne vont pas présenter de réponse rénale complète après un traitement d’induction et 10 à 30% des néphrites lupiques vont évoluer vers l’insuffisance rénale chronique terminale dans les 10 à 20 ans après le diagnostic.
L’Obinutuzumab est un anticorps monoclonal anti-CD20 de type II qui a une capacité déplétion des lymphocytes B circulants supérieure à celle des anti-CD20 de type I (p. ex : Rituximab). L’Obinutuzumab a montré une amélioration significative des réponses rénales dans l’essai de phase 2 (NOBILITY) comparé au placebo chez des patients sous MMF corticoïdes seuls et une analyse post hoc de cet essai suggère une efficacité sur les rechutes de néphrite lupique.
L’essai de phase 3 REGENCY évalue l’efficacité et la sécurité de l’Obinutuzumab en association avec le traitement standard comme traitement d’induction de la néphrite lupique active chez les patients adultes avec une néphrite lupique active
Méthodes
REGENCY (NCT04221477) est un essai multinational (15 pays), randomisé, en double aveugle, incluant des adultes avec une néphropathie lupique active histologiquement confirmée (classe III-IV +/- V, biopsie <6 mois), un DFGe >= 30mL/min/1.73m² et un ratio protéinurie/créatininurie >= 1g/g.
Les participants ont été randomisé avec un ratio 1:1 à recevoir soit de l’Obinutuzumab (1000 mg à J1, puis semaines 2, 24, 26 et 52, avec ou sans dose à la semaine 50) soit un placebo. Tous les patients ont reçu un d’induction comprenant du mycophénolate mofétil 2-3g/jour et une corticothérapie orale, avec un objectif de décroissance à 7,5 mg/j de prednisone à la semaine 12 et à 5 mg/j à la semaine 24.
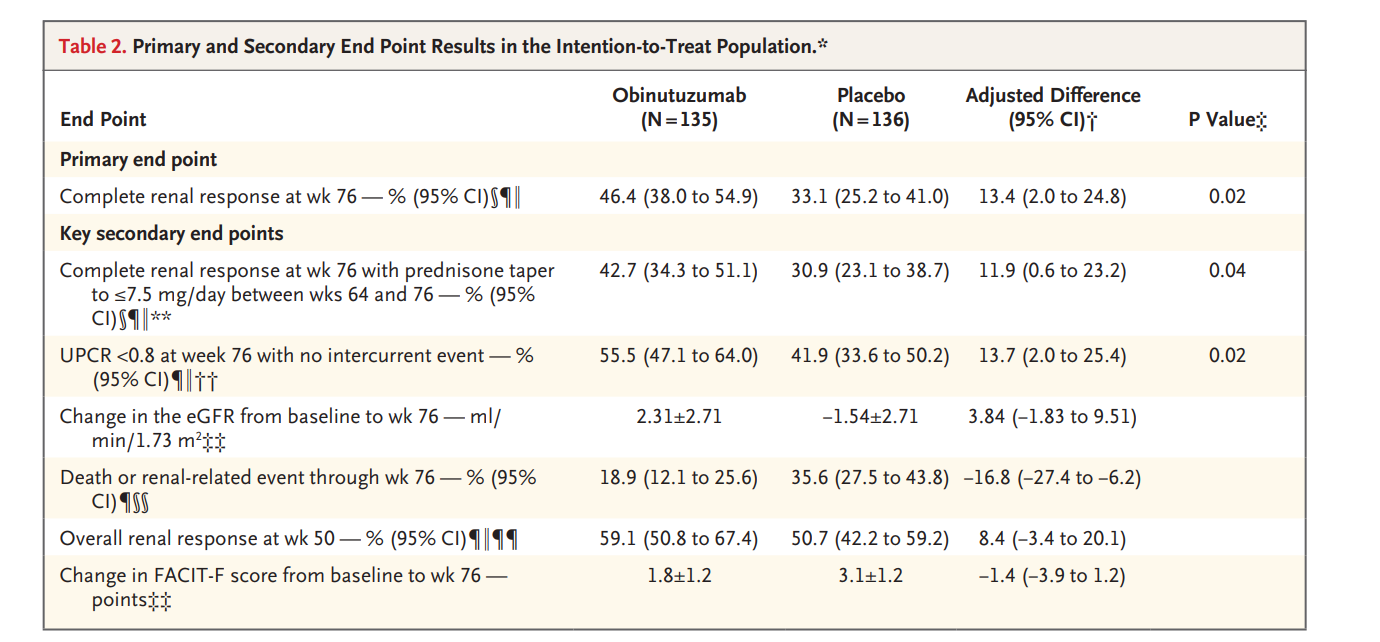
Le critère principal d’évaluation était une réponse rénale complète à la semaine 76, définie par un ratio protéinurie/créatinine urinaire <0,5g/g, un taux de filtration glomérulaire estimé ≥ 85 % de la valeur de base, et l’absence d’événement intercurrent (thérapie immuno-modulatrice de secours, échec du traitement, décès ou abandon précoce).
Les critères secondaires comprenaient :
- Une réponse rénale complète avec une décroissance effective de la corticothérapie, avec prednisone ≤ 7,5 mg/j entre les semaines 64 et 76
- Un ratio protéinurie/créatinine <0,8 mg/mg sans événement intercurrent.
Résultats
Au total, 271 patients ont été randomisés : 135 dans le groupe Obinutuzumab et 136 dans le groupe placebo. A l’inclusion, 84.4% et 84.6% des patients inclus dans le bras traité et le bras placebo étaient des femmes. Les patients caucasiens représentaient 48% de la cohorte finale. Il s’agissait d’une première poussée de néphrite lupique chez 54/135 (40%) patients dans le bras traité et 60/136 (44.1%) patients dans le bras contrôle. Le DFGe moyen était de 107mL/min/1.73m² avec une protéinurie de 2.13g/g dans le bras traité.
Critère d’évaluation principal :
Une réponse rénale complète à la semaine 76 a été observée chez 46,4 % des patients sous Obinutuzumab contre 33,1 % sous placebo (différence ajustée 13,4 %; IC 95 %, 2,0 à 24,8 ; p = 0,02).
Concernant les critères secondaires :
- Une réponse rénale complète avec prednisone ≤ 7,5 mg/j a été observée chez 42,7 % des patients sous Obinutuzumab contre 30,9 % sous placebo (différence ajustée 11,9 % ; IC 95 %, 0,6 à 23,2 ; p = 0,04).
- Un ratio protéinurie/créatinine <0,8 mg/mg sans événement intercurrent a été atteint chez 55,5 % des patients sous Obinutuzumab contre 41,9 % sous placebo (différence ajustée 13,7 % ; IC 95 %, 2,0 à 25,4 ; p = 0,02).
- A la semaine 76 : variation de DFGe comparé à J0 : +2.31 +/- 2.71mL/min/1.73m² dans le bras traité et -1.54+/-2.71mL/min/1.73m² (non significatif)
- Les marqueurs immunologiques d’activité du lupus étaient plus faibles dans le bras traité (moins de consommation du C3/C4, taux d’anti ADN natif 40% plus bas à S76)
En termes de sécurité/tolérance :
Les effets indésirables graves étaient plus fréquents dans le groupe Obinutuzumab (32.4% versus 18.2%), principalement liées à des infections, notamment à SARS-Cov2 (8.0%), la période d’inclusion de l’étude s’étant déroulée de juillet 2020 à mars 2023, avec deux décès liés au Covid-19 dans le bras traité et 1 dans le bras placebo. Les autres infections étaient des infections urinaires (2.9%), des pneumopathies infectieuses (2.9%) et des gastroentérites (2.2%). Parmi les effets secondaires on note l’occurrence de neutropénies dans le bras traité (12.5% versus 3.8%).
Conclusion
L’Obinutuzumab en association avec le traitement par MMF et corticoïdes améliore la réponse rénale chez les patients atteints de néphropathie lupique active par rapport au traitement par MMF et Corticoides seuls. De façon attendue, les infections étaient plus fréquentes avec l’Obinutuzumab avec au premier plan des infections respiratoires.
Commentaires :
- Ces résultats confirment la place potentielle de la lymphodéplétion B par obinutuzumab comme option thérapeutique dans le traitement d’induction de la néphrite lupique (classe IV +/- V surtout).
- Intérêt plus limité d’une intensification de l’immunosuppression pour les classes III qui répondent déjà bien au traitement par MMF / corticoïdes (réponse rénale complète 50% bras traité et 41% dans le bras placebo pour les classes III+/-V). Intérêt potentiellement plus important pour les classes IV (taux réponse rénale complète 44% versus 28%) et pour les classes V associées (taux réponse rénale complète 49% versus 24%)
- Attention au risque infectieux et à la mise à jour du calendrier vaccinal avant traitement.
- Les données sur l’évolution du DFGe à 2 ans ne sont pas encore disponibles.
- Deux PHRC français sont en cours :
- OBILUP évalue d’efficacité de l’obinutuzumab utilisé à visée d’épargne cortisonique dans le traitement d’induction de néphrite lupique
- OBLUMEN évalue d’efficacité de l’obinutuzumab dans la GEM lupique (classe V pure)