BJN#83 – EXPEDITION-4 : Enfin un traitement anti-VHC chez l’Insuffisant Rénal Terminal
Glecaprevir and Pibrentasvir in Patients with HCV and Severe Renal Impairment
Merci à Christophe Masset, Interne de Néphrologie à Nantes et membre du conseil scientifique du CJN, pour cette synthèse bibliographique. Vous aussi, n’hésitez pas à nous envoyer vos lectures !
Introduction
L’hépatite C est plus fréquente chez les patients Insuffisants Rénaux Chroniques et entraine un surrisque de Maladie Rénale Chronique. Les nouveaux antiviraux directs ont révolutionné sa prise en charge ces dernières années, néanmoins peu voire pas de combinaisons ont été validées chez l’insuffisant rénal, notamment du fait de leur élimination rénale.
Cette étude évalue l’efficacité et la sécurité d’une combinaison Glecaprevir + Pibrentasvir (G+P), dont l’élimination est biliaire, chez les patients Insuffisants Rénaux.
Patients/matériels et méthodes
Cette étude multicentrique incluait des patients VHC chronique (tous génotypes) dont la clairance était inférieure à 30ml/min, dialysés ou non, et ayant eu ou non un antécédent de traitement contre l’hépatite C. Les patients recevaient une bithérapie Glecaprevir 300mg/j + Pibrentasvir 120mg/j pendant une durée de 12 semaines. Le critère de jugement principal était une réponse virologique soutenue 12 semaines après la fin du traitement (ARN VHC < 15UI/ml) et les effets indésirables clinico- biologiques étaient évalués durant l’étude et jusque 4 semaines après la prise du traitement.
Résultats
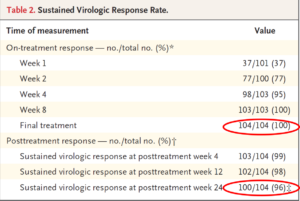
104 patients ont été inclus, parmi lesquels 87% avaient une MRC stade V, 82% étaient hémodialysés, 19% avaient une cirrhose compensée. 52% des patients avaient un VHC génotype I et le DFG des patients non dialysés étaient de 20ml/min en moyenne. La réplication moyenne du VHC avant traitement était de 5,9 log10 UI/ml. 98% des patients (102/104) avaient une réponse virologique soutenue 12 semaines à la fin du traitement, et 96% (100/104) à 24 mois (2 patients perdus de vue). Les 2 échecs thérapeutiques étaient liés à un décès précoce à la suite d’un AVC hémorragique (non lié au traitement), et à un arrêt du traitement lié à d’importantes diarrhées (potentiellement lié au traitement). Parmi les effets indésirables imputés au traitement, on notait 21% de prurit, 14% d’asthénie, et 12% de nausées. A noter la survenue chez 6 patients préalablement hypertendus d’évènements cardiovasculaires graves, non liés au traitement selon les investigateurs. Biologiquement, le traitement par G+P n’induisait pas de perturbation du bilan hépatique, pas d’anémie, et n’altérait pas la fonction rénale des patients non dialysés. L’analyse pharmacologique réalisée ne montrait pas de perturbation de la concentration maximal ni de l’AUC lors de la réalisation de l’hémodialyse.
Conclusion
Le traitement par G+P permet d’obtenir une réponse virologique VHC soutenue chez les patients IRT stade IV/V, sans effets indésirables graves relatés.
Les plus du papier
- Phase III Multicentrique
- Peu de perdus de vue
- 1ere étude chez l’Insuffisant Rénal Terminal des nouveaux antiviraux HCV tous génotypes confondus
Les critiques
- Pas de groupe contrôle
- Pas (encore) de data sur les patients IRT immunodéprimés