Les jeunes Néphrologues publient #4 : Roles of APOL1 G1 and G2 variants in sickle cell disease patients: kidney is the main target
Le CJN s’attache à mettre en avant les travaux scientifiques de ses membres et de la jeune génération néphrologique. Nous relayons ici l’article de Raphaël Kormann et son équipe (Paris), dans le British Journal of Haematology. Félicitation à eux pour ce beau travail!
Roles of APOL1 G1 and G2 variants in sickle cell disease patients: kidney is the main target
Raphaël Kormann,1,2 Anne-Sophie Jannot,2,3,4, Celine Narjoz,2,5,6, Jean-Antoine Ribeil,2,7,8,9, Sandra Manceau,2,7 Marianne Delville,2,7,9 Valentin Joste,2,5 Dominique Prie,2,10,11 Jacques Pouchot,2,12 Eric Thervet,2,6,13 Marie Courbebaisse1,2,10, and JeanBenoît Arlet2,12,14,
http://onlinelibrary.wiley.com/doi/10.1111/bjh.14842/abstract
1 Physiology Department, Georges Pompidou European Hospital, APHP, 2 Paris Descartes Faculty of Medicine, 3 INSERM UMR 1138- E22: Information Sciences & Personalized Medicine, 4 Medical Informatics, Biostatistics and Public Health Department, Georges Pompidou University Hospital, 5 Biochemistry Department, Georges Pompidou European Hospital, APHP, 6 Institut National pour la Sante et la Recherche Medicale (INSERM) UMR-S 1147, 7 Biotherapy Department, Necker Children’s Hospital, APHP, 8 Biotherapy Clinical Investigation Centre, Groupe Hospitalier Universitaire Ouest, APHP, INSERM, 9 Centre de Reference des Syndromes Drepanocytaires Majeurs, Necker-Enfants-Malades University Hospital, APHP, Universite Paris 5, 10 INSERM U1151-CNRS UMR8253, 11 AP-HP, Necker Children’s Hospital, Physiology Department, Paris Descartes University, 12 Internal Medicine Department, Sickle Cell Referral Centre, Faculté de Médecine Paris Descartes, Sorbonne Paris-Cité et APHP, Georges Pompidou University Hospital, 13 Department of Nephrology, Georges Pompidou University Hospital, APHP, and 14Laboratory of Excellence GR-Ex, Paris, France Receiv
Résumé :
Les variants APOL1 G1 et G2 sont associés à un risque accru de néphropathie drépanocytaire chez les patients afro-américains atteints de drépanocytose.
Pour déterminer le rôle des variants de APOL1 dans une population de patients drépanocytaires vivants en Europe, nous avons génotypé 152 patients atteint de drépanocytose [âge 30,4 (24,3 – 36,4) années], principalement d’origine sub-saharienne, pour les variants G1 et G2 de APOL1 et pour quatre autres variants (GSTM1, GSTT1, GSTP1 et HMOX). Les génotypes homozygotes ou double hétérozygotes pour APOL1 G1 et G2 étaient fortement associés avec l’insuffisance rénale terminale (p = 0,003) et avec le stade KDIGO (p=0,001). De plus, ces génotypes étaient associés d’une manière âge-dépendante avec un plus faible débit de filtration glomérulaire (DFG, p = 0,008), une plus forte protéinurie (p=0,009) et une plus forte albuminurie (p<0,001), mais pas avec les autres complications habituelles de la drépanocytose. Comparé aux génotypes hétérozygote G1/allèle sauvage, les génotypes G2/allèle sauvage étaient associés à un DFG plus faible (p=0,04) de façon dépendante de l’âge, suggérant que les patients G2/allèle sauvage ont un pronostic rénal plus défavorable. Aucune autre association n’a été retrouvée entre les autres variants étudiés et les atteintes drépanocytaires.
Nos données indiquent que la recherche des variants d’APOL1 devrait être considérée pour la prise en charge des patients drépanocytaires, incluant ceux d’origine autres que afro-américain, étant donné que les patients homozygotes ou double hétérozygotes pour les variants G1 et G2 de APOL1 sont clairement plus à risque de développer une néphropathie drépanocytaire.
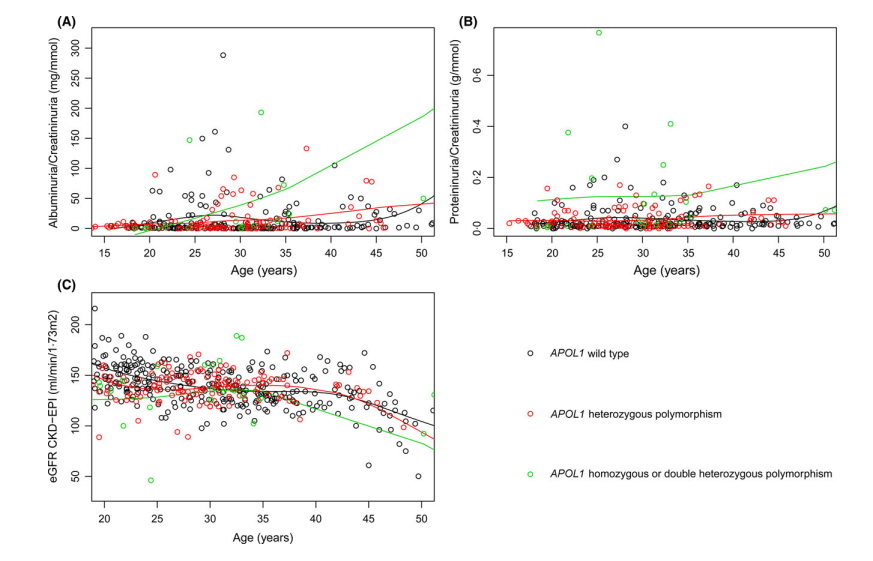
Évolution de (A) albuminurie / créatininurie, (B) protéinurie / créatininurie, et (C) eGFR en fonction de l’âge chaque patient atteint de drépanocytose et leur haplotype APOL1. Chaque cercle représente une valeur enregistrée pour un individu. Les lignes colorées représentent les moyennes de toutes les valeurs disponibles pour chaque haplotype APOL1.